
京都農販日誌
キレート剤とキレート鉄
2024/04/24
キレート剤についての話題が挙がりました。
キレート剤は水耕栽培をされている方でEDTA鉄等で愛用されている事があると思いますので、今回はEDTAというキレート剤を中心にして見ていくことにします。
キレート剤と聞いて真っ先に思い浮かぶのが、鉄等の植物に吸収させにくい養分をキレート剤によって吸収させやすい形にして施肥するあたりになるかと思います。
キレート鉄が頻繁に使用されるようになる前は硫酸鉄(FeSO4)のような無機塩が使用されていたそうですが、溶液中の環境(pH)によって効きにくく(不溶化)なりやすく、養液の交換も頻繁に発生するそうです。
キレート鉄を使用する事によって上記の問題は小さくなりました。
丸尾達 養液栽培における鉄の限界濃度について ハイドロポニックス 13(2) 120-122 2000
本題に入る前に肥料の効き方の復習ですが、栽培で肥料が効く為には必ず水に溶けた状態でなければなりません。
硫酸鉄であれば水には溶けやすいのですが、pHの高い環境ではすぐに沈殿(不溶化:水に溶けていない状態)し、肥効がなくなります。
沈殿する事によって、養液の詰まりの要因になり、頻繁な水交換が必要になります。
これらの背景を基にして、キレート剤とキレート化された鉄(以後はキレート鉄と略します)ついてに見ていきましょう。
先に注意ですが、養液栽培で使用するキレート鉄では、EDTA鉄よりDPTA鉄が推奨されていますが、説明の便宜上、キレート鉄 = EDTA鉄で話を進めます。
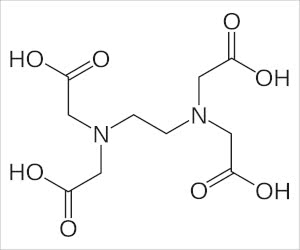
EDTAはエチレンジアミン四酢酸の略で、他にはエデト酸とも略されたりします。
水に溶けると、
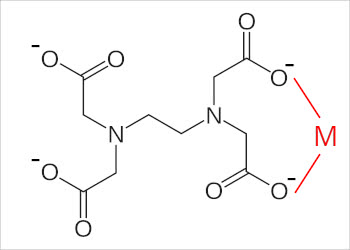
端の四箇所にあるOHからHが外れて、金属(上の図ではMと表記しています)を掴む手ができます。
キレート剤の手が金属を捉えることをキレート結合と呼びます。
※キレート結合の詳細説明はキレート錯体という用語がセットで必要になりますが、難易度が上がりますので、この場では省略します。
EDTAはカルシウム(Ca2+)、銅(Cu2+)と鉄(Fe3+)等と結合します。
ここで一つ疑問が生じるかもしれません。
鉄(Fe3+)は3価の陽イオンなので、片側の二本の手では鉄を掴むことができないのでは?
これは先程、説明を端折ったキレート錯体というものが関わっていて、
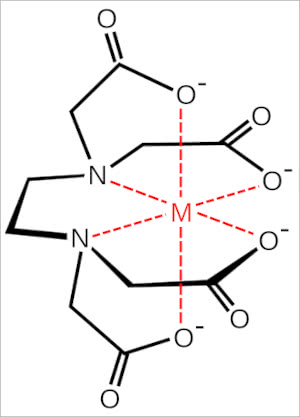
反対側の二本の手も関わり、中心にあるNも関わって、一つの金属を捉えます。
この挟み込む事からカニのハサミが連想され、カニのハサミのラテン語読みからキレートと呼ばれるそうです。
実際、鉄をどのように捉えているか?を確認してみますと、
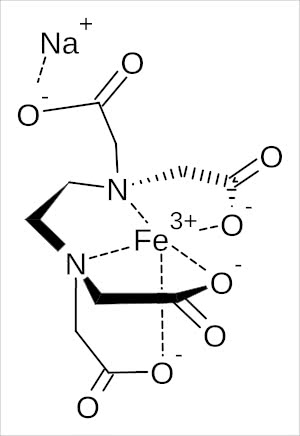
三本の手で鉄を掴み、余った一つの手で他の一価の金属(上の図ではナトリウム:Na)と結合しています。
EDTAと結合した鉄は冒頭で挙げました硫酸鉄よりは水に溶けにくくなり、肥効は遅くなりますが、肥効に関係ない余りの不溶化を避ける事ができ、養液栽培の管理コストを高める事ができます。
※養液中のpHによってキレート結合の強度が異なります
あまりないとは思いますが、キレート剤そのものを購入して利用したいという事があるかもしれません。
この時、EDTAを購入しようとすると、実験試薬と取り扱いになりますので、購入は難しいです。
身近なものでキレート剤に成り得るものがあるか?を探してみますと、

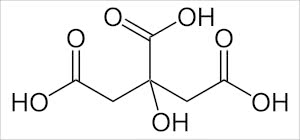
ドラックストアで購入できるクエン酸もキレート剤として働く事ができます。